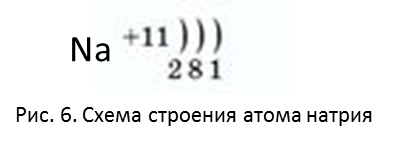Ребята, сегодня в ходе урока вы узнаете как устроен атом, что означает порядковый номер элемента в периодической таблице, научитесь определять заряд ядра и число электронов в нейтральном атоме каждого элемента по таблице Д.И. Менделеева, а также сможете понять почему свойства элементов в периодах изменяются периодически.
Вам необходимо:внимательно изучить §52,§53; посмотреть видеоурок; составить конспект в тетради; выполнить письменно задание для закрепления материала; подготовиться к контрольному тесту по данной теме, который будет опубликован 24.04.2020г.
ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ ИЗУЧЕННОГО МАТЕРИАЛА:
1. Какое строение имеют атомы химических элементов?
2. Что общего в строении атомов химических элементов, расположенных в одной А-группе?
3. Что общего в строении атомов химических элементов, расположенных в одном периоде?
4. Укажите порядковый номер, заряд ядра и рассчитайте число протонов, нейтронов и электронов в атомах бора (массовое число 11), меди (массовое число 63), олова (массовое число 118), углерода (массовое число 12), цинка (массовое число 64) и брома (массовое число 79).
5. Напишите электронные формулы атомов азота и алюминия.
6. Напишите не менее трех символов химических элементов, у которых на внешнем энергетическом уровне находится четыре электрона. Изобразите схему строения атома и электронную формулу одного из них.
ДОПОЛНИТЕЛЬНЫЙ МАТЕРИАЛ
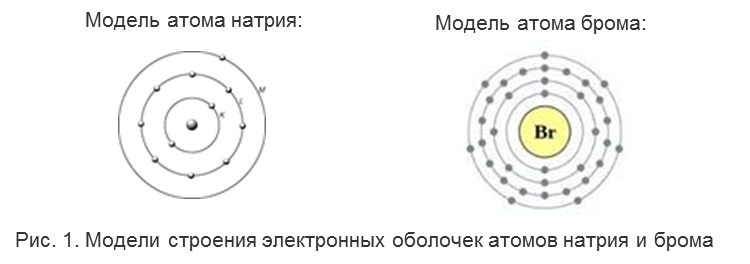
Атом состоит из ядра и электронов. Ядро состоит из протонов и нейтронов и находится в центре атома каждого элемента, а электроны, образующие электронную оболочку, размещаются вокруг ядра слоями. Число электронных слоев в атоме элемента равно номеру периода, в котором находится данный элемент. Например, натрий Na – элемент 3-го периода, значит, его электронная оболочка включает 3 энергетических уровня. В атоме брома Br – 4 энергетических уровня, т. к. бром расположен в 4-м периоде (Рис. 1).
Максимальное число электронов на энергетическом уровне рассчитывается по формуле: 2n2, где n – номер энергетического уровня.
Таким образом, максимальное число электронов на:
1 слое – 2
2 слое – 8
3 слое – 18 и т. д.
У элементов главных подгрупп номер группы, к которой относится элемент, равен числу внешних электронов атома. Внешними называют электроны последнего электронного слоя. Например, в атоме натрия – 1 внешний электрон (т. к. это элемент IА подгруппы). В атоме брома – 7 электронов на последнем электронном слое (это элемент VIIА подгруппы).
Рассмотрим строение электронных оболочек элементов 1–3 периодов
В атоме водорода заряд ядра равен +1, и этот заряд нейтрализуется единственным электроном (Рис. 2).
Следующий за водородом элемент – гелий, тоже элемент 1-го периода. Следовательно, в атоме гелия 1 энергетический уровень, на котором размещаются два электрона (Рис. 3). Это максимально возможное число электронов для первого энергетического уровня.
Элемент № 3 – это литий. В атоме лития 2 электронных слоя, т. к. это элемент 2-го периода. На 1 слое в атоме лития находится 2 электрона (этот слой завершен), а на 2 слое –1 электрон. В атоме бериллия на 1 электрон больше, чем в атоме лития (Рис. 4). 
Аналогично можно изобразить схемы строения атомов остальных элементов второго периода (Рис. 5).
В атоме последнего элемента второго периода – неона – последний энергетический уровень является завершенным (на нем 8 электронов, что соответствует максимальному значению для 2-го слоя). Неон – инертный газ, который не вступает в химические реакции, следовательно, его электронная оболочка очень устойчива.
После неона следует элемент 3-го периода – натрий. В атоме натрия – 3 электронных слоя, на которых расположены 11 электронов (Рис. 6).
Натрий находится в 1 группе, его валентность в соединениях равна I, как и у лития. Это связано с тем, что на внешнем электронном слое атомов натрия и лития находится 1 электрон.
Свойства элементов периодически повторяются потому, что у атомов элементов периодически повторяется число электронов на внешнем электронном слое.Строение атомов остальных элементов третьего периода можно представить по аналогии со строением атомов элементов 2-го периода. Четвертый период включает в себя 18 элементов, среди них есть элементы как главной (А), так и побочной (В) подгрупп. Особенностью строения атомов элементов побочных подгрупп является то, что у них последовательно заполняются предвнешние (внутренние), а не внешние электронные слои.